Οι αρχές του 20ού αιώνα ήταν μια πολύ ευοίωνη εποχή για τις επιστήμες. Εκτός από τον Ernest Rutherford και τον Niels Bohr που γεννήθηκαν το πρότυπο μοντέλο της φυσικής των σωματιδίων, ήταν επίσης μια περίοδος ανακαλύψεων στον τομέα της κβαντικής μηχανικής. Χάρη στις συνεχιζόμενες μελέτες σχετικά με τη συμπεριφορά των ηλεκτρονίων, οι επιστήμονες άρχισαν να προτείνουν θεωρίες σύμφωνα με τις οποίες αυτά τα στοιχειώδη σωματίδια συμπεριφέρθηκαν με τρόπους που αψηφούσαν την κλασική, Νεύτωνα φυσική.
Ένα τέτοιο παράδειγμα είναι το Electron Cloud Model που πρότεινε ο Erwin Schrodinger. Χάρη σε αυτό το μοντέλο, τα ηλεκτρόνια δεν απεικονίζονται πλέον ως σωματίδια που κινούνται γύρω από έναν κεντρικό πυρήνα σε μια σταθερή τροχιά. Αντ 'αυτού, ο Schrodinger πρότεινε ένα μοντέλο σύμφωνα με το οποίο οι επιστήμονες μπορούσαν να κάνουν μόνον μορφωμένες εικασίες σχετικά με τις θέσεις των ηλεκτρονίων. Ως εκ τούτου, οι τοποθεσίες τους μπορούσαν να περιγραφούν μόνο ως μέρος ενός «νέφους» γύρω από τον πυρήνα όπου είναι πιθανό να βρεθούν τα ηλεκτρόνια.
Ατομική Φυσική στον 20ο αιώνα:
Τα πρώτα γνωστά παραδείγματα ατομικής θεωρίας προέρχονται από την αρχαία Ελλάδα και την Ινδία, όπου φιλόσοφοι όπως ο Δημόκριτος ισχυρίστηκαν ότι όλη η ύλη αποτελείται από μικροσκοπικές, αδιαίρετες και άφθαρτες μονάδες. Ο όρος «άτομο» επινοήθηκε στην αρχαία Ελλάδα και δημιούργησε τη σχολή σκέψης γνωστή ως «ατομισμός». Ωστόσο, αυτή η θεωρία ήταν περισσότερο φιλοσοφική αντί για επιστημονική.
Μόνο τον 19ο αιώνα η θεωρία των ατόμων έγινε αρθρωτή ως επιστημονική ύλη, με τα πρώτα πειράματα που βασίζονται σε στοιχεία. Για παράδειγμα, στις αρχές του 1800, ο Άγγλος επιστήμονας John Dalton χρησιμοποίησε την έννοια του ατόμου για να εξηγήσει γιατί τα χημικά στοιχεία αντέδρασαν με ορισμένους παρατηρήσιμους και προβλέψιμους τρόπους. Μέσα από μια σειρά πειραμάτων που αφορούσαν αέρια, ο Dalton συνέχισε να αναπτύσσει αυτό που είναι γνωστό ως η ατομική θεωρία του Dalton.
Αυτή η θεωρία επεκτάθηκε στους νόμους της συνομιλίας της μάζας και των συγκεκριμένων αναλογιών και κατέληξε σε πέντε υποθέσεις: τα στοιχεία, στην πιο καθαρή τους κατάσταση, αποτελούνται από σωματίδια που ονομάζονται άτομα. τα άτομα ενός συγκεκριμένου στοιχείου είναι όλα τα ίδια, μέχρι το τελευταίο άτομο. άτομα διαφορετικών στοιχείων μπορούν να ξεχωρίζουν από τα ατομικά τους βάρη. άτομα των στοιχείων ενώνονται για να σχηματίσουν χημικές ενώσεις Τα άτομα δεν μπορούν ούτε να δημιουργηθούν ούτε να καταστραφούν σε χημική αντίδραση, αλλά μόνο η ομαδοποίηση αλλάζει.
Ανακάλυψη του ηλεκτρονίου:
Στα τέλη του 19ου αιώνα, οι επιστήμονες άρχισαν επίσης να θεωρούν ότι το άτομο αποτελείται από περισσότερες από μία θεμελιώδεις μονάδες. Ωστόσο, οι περισσότεροι επιστήμονες τολμούσαν ότι αυτή η μονάδα θα ήταν το μέγεθος του μικρότερου γνωστού ατόμου - υδρογόνου. Μέχρι το τέλος του 19ου αιώνα, θα άλλαζε δραστικά, χάρη στην έρευνα που διεξήχθη από επιστήμονες όπως ο Sir Joseph John Thomson.
Μέσα από μια σειρά πειραμάτων χρησιμοποιώντας καθοδικούς σωλήνες (γνωστός ως Crookes ’Tube), ο Thomson παρατήρησε ότι οι ακτίνες καθόδου θα μπορούσαν να εκτραπούν από ηλεκτρικά και μαγνητικά πεδία. Κατέληξε στο συμπέρασμα ότι, αντί να αποτελούνται από φως, αποτελούνται από αρνητικά φορτισμένα σωματίδια που ήταν 1ooo φορές μικρότερα και 1800 φορές ελαφρύτερα από το υδρογόνο.

Αυτό απέδειξε αποτελεσματικά την ιδέα ότι το άτομο υδρογόνου ήταν η μικρότερη μονάδα ύλης και ο Thompson προχώρησε περαιτέρω για να υποδηλώσει ότι τα άτομα ήταν διαιρετά. Για να εξηγήσει το συνολικό φορτίο του ατόμου, το οποίο συνίστατο τόσο από θετικά όσο και από αρνητικά φορτία, ο Thompson πρότεινε ένα μοντέλο σύμφωνα με το οποίο τα αρνητικά φορτισμένα «πτώματα» διανεμήθηκαν σε μια ομοιόμορφη θάλασσα θετικού φορτίου - γνωστό ως το Plum Pudding Model.
Αυτά τα πτώματα θα ονομάζονταν αργότερα «ηλεκτρόνια», με βάση το θεωρητικό σωματίδιο που προέβλεπε ο Αγγλο-Ιρλανδός φυσικός George Johnstone Stoney το 1874. Και από αυτό, το μοντέλο Plum Pudding γεννήθηκε, ονομάστηκε έτσι επειδή μοιάζει πολύ με την αγγλική έρημο που αποτελείται από δαμάσκηνο και σταφίδες. Η ιδέα εισήχθη στον κόσμο την έκδοση Μαρτίου του 1904 του Ηνωμένου Βασιλείου Φιλοσοφικό Περιοδικό, σε ευρεία αναγνώριση.
Ανάπτυξη του τυπικού μοντέλου:
Τα επόμενα πειράματα αποκάλυψαν ορισμένα επιστημονικά προβλήματα με το μοντέλο Plum Pudding. Για αρχάριους, υπήρχε το πρόβλημα της απόδειξης ότι το άτομο είχε ένα ομοιόμορφο θετικό φορτίο φόντου, το οποίο έγινε γνωστό ως "Πρόβλημα Thomson". Πέντε χρόνια αργότερα, το μοντέλο θα απορριφθεί από τους Hans Geiger και Ernest Marsden, οι οποίοι διεξήγαγαν μια σειρά πειραμάτων χρησιμοποιώντας σωματίδια άλφα και αλουμινόχαρτο. το «πείραμα χρυσού φύλλου».
Σε αυτό το πείραμα, οι Geiger και Marsden μέτρησαν το μοτίβο σκέδασης των σωματιδίων άλφα με μια οθόνη φθορισμού. Εάν το μοντέλο του Thomson ήταν σωστό, τα σωματίδια άλφα θα περνούσαν από την ατομική δομή του φύλλου χωρίς εμπόδια. Ωστόσο, σημείωσαν ότι ενώ οι περισσότεροι πυροβόλησαν κατευθείαν, μερικές από αυτές ήταν διασκορπισμένες σε διάφορες κατευθύνσεις, με κάποιες να επιστρέφουν προς την κατεύθυνση της πηγής.

Ο Geiger και ο Marsden κατέληξαν στο συμπέρασμα ότι τα σωματίδια αντιμετώπισαν ηλεκτροστατική δύναμη πολύ μεγαλύτερη από αυτήν που επέτρεπε το μοντέλο του Thomson. Δεδομένου ότι τα σωματίδια άλφα είναι μόνο πυρήνες ηλίου (οι οποίοι είναι θετικά φορτισμένοι) αυτό υπονοούσε ότι το θετικό φορτίο στο άτομο δεν ήταν ευρέως διασκορπισμένο, αλλά συγκεντρώθηκε σε μικρό όγκο. Επιπλέον, το γεγονός ότι αυτά τα σωματίδια που δεν παραμορφώθηκαν περνούσαν απρόσκοπτα σήμαινε ότι αυτοί οι θετικοί χώροι χωρίστηκαν από τεράστιους κόλπους κενού χώρου.
Μέχρι το 1911, ο φυσικός Ernest Rutherford ερμήνευσε τα πειράματα Geiger-Marsden και απέρριψε το μοντέλο του ατόμου του Thomson. Αντ 'αυτού, πρότεινε ένα μοντέλο όπου το άτομο αποτελούταν κυρίως από κενό χώρο, με όλο το θετικό του φορτίο να συγκεντρώνεται στο κέντρο του σε έναν πολύ μικρό όγκο, που περιβάλλεται από ένα σύννεφο ηλεκτρονίων. Αυτό έγινε γνωστό ως το μοντέλο Rutherford του ατόμου.
Τα επόμενα πειράματα των Antonius Van den Broek και Niels Bohr βελτίωσαν περαιτέρω το μοντέλο. Ενώ ο Van den Broek πρότεινε ότι ο ατομικός αριθμός ενός στοιχείου είναι πολύ παρόμοιος με το πυρηνικό του φορτίο, το τελευταίο πρότεινε ένα μοντέλο του ατόμου που μοιάζει με ηλιακό σύστημα, όπου ένας πυρήνας περιέχει τον ατομικό αριθμό θετικού φορτίου και περιβάλλεται από ένα ίσο αριθμός ηλεκτρονίων σε τροχιακά κελύφη (γνωστό και ως μοντέλο Bohr).
Το Ηλεκτρονικό Μοντέλο Cloud:
Κατά τη διάρκεια της δεκαετίας του 1920, ο Αυστριακός φυσικός Erwin Schrodinger γοητεύτηκε από τις θεωρίες Max Planck, Albert Einstein, Niels Bohr, Arnold Sommerfeld και άλλους φυσικούς. Κατά τη διάρκεια αυτής της περιόδου, ασχολήθηκε επίσης με τους τομείς της ατομικής θεωρίας και φασμάτων, ερευνώντας στο Πανεπιστήμιο της Ζυρίχης και στη συνέχεια στο Πανεπιστήμιο Friedrich Wilhelm στο Βερολίνο (όπου διαδέχθηκε το Planck το 1927).

Το 1926, ο Schrödinger αντιμετώπισε το ζήτημα των κυματομορφών και των ηλεκτρονίων σε μια σειρά από χαρτιά. Εκτός από την περιγραφή του τι θα γινόταν γνωστό ως εξίσωση Schrodinger - μια μερική διαφορική εξίσωση που περιγράφει πώς η κβαντική κατάσταση ενός κβαντικού συστήματος αλλάζει με το χρόνο - χρησιμοποίησε επίσης μαθηματικές εξισώσεις για να περιγράψει την πιθανότητα εύρεσης ενός ηλεκτρονίου σε μια συγκεκριμένη θέση .
Αυτό έγινε η βάση αυτού που θα γινόταν γνωστό ως Μοντέλο Ηλεκτρονικού Cloud (ή κβαντικού μηχανικού), καθώς και η εξίσωση Schrodinger. Με βάση την κβαντική θεωρία, η οποία δηλώνει ότι όλη η ύλη έχει ιδιότητες που σχετίζονται με μια λειτουργία κύματος, το Μοντέλο Cloud Ηλεκτρονίου διαφέρει από το Μοντέλο Bohr στο ότι δεν καθορίζει την ακριβή διαδρομή ενός ηλεκτρονίου.
Αντ 'αυτού, προβλέπει την πιθανή θέση της θέσης του ηλεκτρονίου με βάση μια συνάρτηση πιθανοτήτων. Η συνάρτηση πιθανότητας περιγράφει βασικά μια περιοχή που μοιάζει με σύννεφο όπου είναι πιθανό να βρεθεί το ηλεκτρόνιο, εξ ου και το όνομα. Όπου το σύννεφο είναι πιο πυκνό, η πιθανότητα εύρεσης του ηλεκτρονίου είναι μεγαλύτερη. και όπου το ηλεκτρόνιο είναι λιγότερο πιθανό να είναι, το νέφος είναι λιγότερο πυκνό.
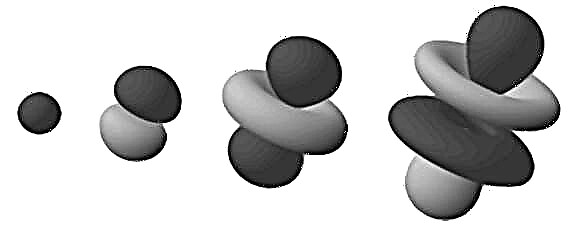
Αυτές οι πυκνές περιοχές είναι γνωστές ως «τροχιακά ηλεκτρονίων», καθώς είναι η πιο πιθανή τοποθεσία όπου θα βρεθεί ένα ηλεκτρόνιο σε τροχιά. Επεκτείνοντας αυτό το μοντέλο "cloud" σε έναν τρισδιάστατο χώρο, βλέπουμε ένα barbell ή ένα σχήμα λουλουδιού άτομο (όπως στην εικόνα στην κορυφή). Εδώ, οι περιοχές διακλάδωσης είναι αυτές όπου είναι πιο πιθανό να βρούμε τα ηλεκτρόνια.
Χάρη στο έργο του Schrodinger, οι επιστήμονες άρχισαν να καταλαβαίνουν ότι στον τομέα της κβαντικής μηχανικής, ήταν αδύνατο να γνωρίζουμε την ακριβή θέση και ορμή ενός ηλεκτρονίου ταυτόχρονα. Ανεξάρτητα από το τι ξέρει αρχικά ο παρατηρητής για ένα σωματίδιο, μπορούν να προβλέψουν μόνο την επόμενη θέση ή την ορμή του ως προς τις πιθανότητες.
Σε καμία δεδομένη στιγμή δεν θα είναι σε θέση να εξακριβώσουν κανένα. Στην πραγματικότητα, όσο περισσότερα γνωρίζουν για την ορμή ενός σωματιδίου, τόσο λιγότερα θα γνωρίζουν για τη θέση του και αντίστροφα. Αυτό είναι γνωστό σήμερα ως «Αρχή της αβεβαιότητας».
Σημειώστε ότι τα τροχιακά που αναφέρονται στην προηγούμενη παράγραφο σχηματίζονται από ένα άτομο υδρογόνου (δηλαδή με ένα μόνο ηλεκτρόνιο). Όταν αντιμετωπίζουμε άτομα που έχουν περισσότερα ηλεκτρόνια, οι τροχιακές περιοχές ηλεκτρονίων απλώνονται ομοιόμορφα σε μια σφαιρική ασαφή μπάλα. Αυτό είναι όπου ο όρος «σύννεφο ηλεκτρονίων» είναι πιο κατάλληλος.
Αυτή η συνεισφορά αναγνωρίστηκε παγκοσμίως ως μία από τις σημαντικές ως προς το κόστος συνεισφορές του 20ού αιώνα, και η οποία πυροδότησε μια επανάσταση στους τομείς της φυσικής, της κβαντικής μηχανικής και μάλιστα όλων των επιστημών. Στη συνέχεια, οι επιστήμονες δεν εργάζονταν πλέον σε ένα σύμπαν που χαρακτηριζόταν από απόλυτα χρόνο και χώρο, αλλά από κβαντικές αβεβαιότητες και σχετικότητα χρόνου-χώρου!
Έχουμε γράψει πολλά ενδιαφέροντα άρθρα για άτομα και ατομικά μοντέλα εδώ στο Space Magazine. Εδώ είναι τι είναι το ατομικό μοντέλο του John Dalton ;, Τι είναι το μοντέλο πουτίγκα δαμάσκηνου ;, Ποιο είναι το ατομικό μοντέλο του Bohr ;, Ποιος ήταν δημοκρίτης ;, και ποια είναι τα μέρη ενός ατόμου;
Για περισσότερες πληροφορίες, φροντίστε να ελέγξετε Τι είναι η Κβαντομηχανική; από το Live Science.
Το Astronomy Cast έχει επίσης επεισόδιο στο θέμα, όπως το επεισόδιο 130: Radio Astronomy, Episode 138: Quantum Mechanics και Episode 252: Heisenberg Uncertainty Principle