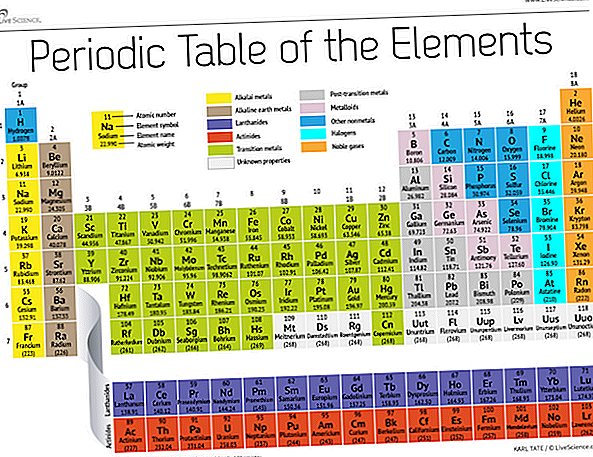
Στα τέλη του 19ου αιώνα, ο ρώσος χημικός Ντμίτρι Μεντελλέεφ δημοσίευσε την πρώτη του προσπάθεια να ομαδοποιήσει χημικά στοιχεία σύμφωνα με τα ατομικά βάρη τους. Στην εποχή εκείνη υπήρχαν μόνο περίπου 60 στοιχεία, αλλά ο Mendeleev συνειδητοποίησε ότι όταν τα στοιχεία οργανώνονται με βάση το βάρος, ορισμένα είδη στοιχείων εμφανίστηκαν σε τακτά χρονικά διαστήματα ή περιόδους.
Σήμερα, 150 χρόνια αργότερα, οι χημικοί αναγνωρίζουν επίσημα 118 στοιχεία (μετά την προσθήκη τεσσάρων νεοφερμένων το 2016) και εξακολουθούν να χρησιμοποιούν τον περιοδικό πίνακα στοιχείων του Mendeleev για να τα οργανώσουν. Ο πίνακας αρχίζει με το απλούστερο άτομο, το υδρογόνο, και στη συνέχεια οργανώνει τα υπόλοιπα στοιχεία με ατομικό αριθμό, ο οποίος είναι ο αριθμός των πρωτονίων που περιέχει ο καθένας. Με λίγες εξαιρέσεις, η σειρά των στοιχείων αντιστοιχεί στην αυξανόμενη μάζα κάθε ατόμου.
Ο πίνακας έχει επτά σειρές και 18 στήλες. Κάθε σειρά αντιπροσωπεύει μία περίοδο. ο αριθμός περιόδου ενός στοιχείου υποδεικνύει πόσες από τις ενεργειακές του στάθμες στεγάζουν ηλεκτρόνια. Το νάτριο, για παράδειγμα, κάθεται στην τρίτη περίοδο, πράγμα που σημαίνει ότι ένα άτομο νατρίου έχει συνήθως ηλεκτρόνια στα πρώτα τρία επίπεδα ενέργειας. Προχωρώντας προς τα κάτω στο τραπέζι, οι περίοδοι είναι μεγαλύτερες, διότι χρειάζονται περισσότερα ηλεκτρόνια για να γεμίσουν τα μεγαλύτερα και πιο σύνθετα εξωτερικά επίπεδα.
Οι στήλες του πίνακα αντιπροσωπεύουν ομάδες ή οικογένειες στοιχείων. Τα στοιχεία μιας ομάδας συχνά φαίνονται και συμπεριφέρονται παρομοίως, επειδή έχουν το ίδιο αριθμό ηλεκτρονίων στο εξωτερικό κέλυφος τους - το πρόσωπο που δείχνουν στον κόσμο. Τα στοιχεία της Ομάδας 18, στην άκρα δεξιά πλευρά του τραπεζιού, για παράδειγμα, έχουν εντελώς πλήρη εξωτερικά κελύφη και σπάνια συμμετέχουν σε χημικές αντιδράσεις.
Τα στοιχεία ταξινομούνται συνήθως είτε ως μέταλλο είτε ως μη μεταλλικά, αλλά η διαχωριστική γραμμή μεταξύ των δύο είναι ασαφής. Τα μεταλλικά στοιχεία είναι συνήθως καλά αγωγοί ηλεκτρισμού και θερμότητας. Οι υποομάδες μέσα στα μέταλλα βασίζονται στα παρόμοια χαρακτηριστικά και τις χημικές ιδιότητες αυτών των συλλογών. Η περιγραφή του περιοδικού πίνακα χρησιμοποιεί κοινά αποδεκτούς συνδυασμούς στοιχείων, σύμφωνα με το Εθνικό Εργαστήριο Los Alamos.
Αλκαλικά μέταλλα: Τα αλκαλικά μέταλλα αποτελούν το μεγαλύτερο μέρος της ομάδας 1, της πρώτης στήλης του πίνακα. Λεία και αρκετά μαλακά για να κόψουν με ένα μαχαίρι, αυτά τα μέταλλα ξεκινούν με λίθιο (Li) και τελειώνουν με francium (Fr). Είναι επίσης εξαιρετικά αντιδραστικά και θα σκάσουν σε φλόγα ή ακόμα και να εκραγούν σε επαφή με το νερό, έτσι ώστε οι χημικοί να τα αποθηκεύουν σε έλαια ή αδρανή αέρια. Το υδρογόνο, με το μόνο του ηλεκτρόνιο, ζει επίσης στην ομάδα 1, αλλά το αέριο θεωρείται μη μεταλλικό.
Μέταλλα αλκαλικών γαιών: Τα μέταλλα των αλκαλικών γαιών αποτελούν την ομάδα 2 του περιοδικού πίνακα, από το βηρύλλιο (Be) μέσω του ραδίου (Ra). Κάθε ένα από αυτά τα στοιχεία έχει δύο ηλεκτρόνια στο εξωτε- ρικό ενεργειακό του επίπεδο, γεγονός που καθιστά τις αλκαλικές γαίες αρκετά αντιδραστικές ώστε σπάνια βρίσκονται στη φύση μόνοι τους. Αλλά δεν είναι τόσο αντιδραστικές όσο τα αλκαλικά μέταλλα. Οι χημικές αντιδράσεις τους συμβαίνουν συνήθως πιο αργά και παράγουν λιγότερη θερμότητα σε σύγκριση με τα αλκαλικά μέταλλα.
Lanthanides: Η τρίτη ομάδα είναι πάρα πολύ μεγάλη για να χωρέσει στην τρίτη στήλη, οπότε σπάζει και γυρίζει προς τα πλάγια για να γίνει η κορυφαία σειρά του νησιού που επιπλέει στο κάτω μέρος του τραπεζιού. Αυτές είναι οι λανθανίδες, τα στοιχεία 57 έως 71 - λανθάνιο (La) έως το λουτέτιο (Lu). Τα στοιχεία αυτής της ομάδας έχουν ασημένιο λευκό χρώμα και αμαυρώνονται κατά την επαφή με τον αέρα.
Ακτινίδια: Οι ακτινίδες ευθυγραμμίζουν την κάτω σειρά του νησιού και περιλαμβάνουν τα στοιχεία 89, ακτινίου (Ac), μέσω του 103, lawrencium (Lr). Από αυτά τα στοιχεία, μόνο θόριο (Th) και ουράνιο (U) εμφανίζονται φυσικά στη Γη σε σημαντικές ποσότητες. Όλα είναι ραδιενεργά. Τα ακτινίδια και οι λανθανίδες σχηματίζουν από κοινού μια ομάδα που ονομάζεται εσωτερικά μεταβατικά μέταλλα.
Μεταβατικά μέταλλα: Επιστρέφοντας στο κυρίως σώμα του πίνακα, οι υπόλοιπες ομάδες 3 έως 12 αντιπροσωπεύουν τα υπόλοιπα μεταβατικά μέταλλα. Σκληρό αλλά εύπλαστο, λαμπερό και με καλή αγωγιμότητα, αυτά τα στοιχεία είναι αυτό που συνήθως σκέφτεστε όταν ακούτε τη λέξη μέταλλο. Πολλά από τα μεγαλύτερα χτυπήματα του μεταλλικού κόσμου - συμπεριλαμβανομένου του χρυσού, του αργύρου, του σιδήρου και της πλατίνας - ζουν εδώ.
Μετά μεταβατικά μέταλλα: Πριν από το άλμα στον μη-μεταλλικό κόσμο, τα κοινά χαρακτηριστικά δεν κατανέμονται ομαλά κατά μήκος κάθετων ομαδικών γραμμών. Τα μετα-μεταβατικά μέταλλα είναι αργίλιο (ΑΙ), γάλλιο (Ga), ίνδιο (Ιη), θάλλιο (ΤΙ), κασσίτερος (Sn), μόλυβδος (Pb) και βισμούθιο (Bi). Αυτά τα στοιχεία έχουν μερικά από τα κλασικά χαρακτηριστικά των μεταβατικών μετάλλων, αλλά τείνουν να είναι πιο μαλακά και να συμπεριφέρονται λιγότερο καλά από άλλα μεταβατικά μέταλλα. Πολλοί περιοδικοί πίνακες θα φέρουν μια έντονη γραμμή "σκάλας" κάτω από τη διαγώνια που συνδέει το βόριο με την αστατίνη. Το συγκρότημα μετα μεταβατικών μετάλλων στο κάτω αριστερό μέρος αυτής της γραμμής.
Μεταλλοειδή: Τα μεταλλοειδή είναι το βόριο (Β), το πυρίτιο (Si), το γερμάνιο (Ge), το αρσενικό (As), το αντιμόνιο (Sb), το τελλούριο (Te) και το πολόνιο (Po). Αποτελούν τη σκάλα που αντιπροσωπεύει τη σταδιακή μετάβαση από μέταλλα σε μη μεταλλικά. Αυτά τα στοιχεία μερικές φορές συμπεριφέρονται σαν ημιαγωγούς (Β, Si, Ge) και όχι ως αγωγοί. Τα μεταλλοειδή ονομάζονται επίσης "ημίμετρα" ή "κακά μέταλλα".
Αμέταλλα: Όλα τα υπόλοιπα στην επάνω δεξιά γωνία της σκάλας - και το υδρογόνο (H), που ξεπερνούν την ομάδα 1 - είναι μη μεταλλικά. Αυτές περιλαμβάνουν άνθρακα (C), άζωτο (Ν), φώσφορο (Ρ), οξυγόνο (Ο), θείο (S) και σελήνιο (Se).
Αλογόνου: Τα τέσσερα κορυφαία στοιχεία της Ομάδας 17, από το φθόριο (F) έως την αστατίνη (At), αντιπροσωπεύουν ένα από τα δύο υποσύνολα των μη μεταλλικών στοιχείων. Τα αλογόνα είναι αρκετά χημικά αντιδραστικά και τείνουν να ζευγαρώσουν με αλκαλικά μέταλλα για να παράγουν διάφορα είδη αλατιού. Το επιτραπέζιο αλάτι στην κουζίνα σας, για παράδειγμα, είναι ένας γάμος μεταξύ του νατρίου αλκαλιμετάλλου και του χλωρίου αλογόνου.
Ευγενή αέρια: Άχρωμο, άοσμο και σχεδόν εντελώς μη αντιδραστικό, τα αδρανή ή τα ευγενή αέρια στρογγυλοποιούνται έξω από το τραπέζι της Ομάδας 18. Πολλοί χημικοί αναμένουν ότι ένα από τα τέσσερα πρόσφατα κατονομαζόμενα στοιχεία θα μοιραστεί αυτά τα χαρακτηριστικά. Ωστόσο, επειδή αυτό το στοιχείο έχει μέτρηση ημιζωής στα χιλιοστά του δευτερολέπτου, κανείς δεν κατάφερε να το δοκιμάσει άμεσα. Ο Oganesson ολοκληρώνει την έβδομη περίοδο του περιοδικού πίνακα, οπότε αν καταφέρει κανείς να συνθέσει το στοιχείο 119 (και ο αγώνας για να γίνει αυτό ήδη βρίσκεται σε εξέλιξη), θα βγάλει γύρω από το βήμα 8 για να ξεκινήσει τη σειρά οκτώ στη στήλη αλκαλικού μετάλλου.
Λόγω της κυκλικής φύσης που δημιουργείται από την περιοδικότητα που δίνει το όνομα του πίνακα, ορισμένοι χημικοί προτιμούν να απεικονίζουν το τραπέζι του Mendeleev ως κύκλο.
Πρόσθετος πόροι: